疫苗被以为是停止此次新冠大盛行,并协助恢复全球经济的最有用办法之一。来自上海交大、复旦大学等组织的联合科研团队最近规划了一款mRNA新冠疫苗。该疫苗经过模仿冠状病毒外表蛋白和内部核酸,然后结合了灭活疫苗和mRNA疫苗的功用,这为全球的抗疫供给了一个全新的疫苗渠道。这款疫苗名为ShaCoVacc,经过单次打针,即可诱导激烈的刺突特异性体液免疫反响,并具有有用的中和活性。
有必要留意一下的是,现在mRNA新冠疫苗还未有动物试验的具体数据发表,该团队供给的数据也是全球首个。以上研讨来自当地时间5月15日,《单剂量SARS-CoV-2模仿颗粒疫苗诱导有用的中和活性》(A single dose SARS-CoV-2 simulating particle vaccine induces potent neutralizing activities),研讨人员来自上海交通大学、复旦大学、上海本导基因技能有限公司、国家北京药物安全点评研讨中心、贵州医科大学。该项研讨的通讯作者为复旦大学根底医学院应天雷研讨员、复旦大学隶属上海眼耳鼻喉科医院副主任医师洪佳旭,以及上海交通大学体系生物医学研讨院蔡宇伽研讨员。
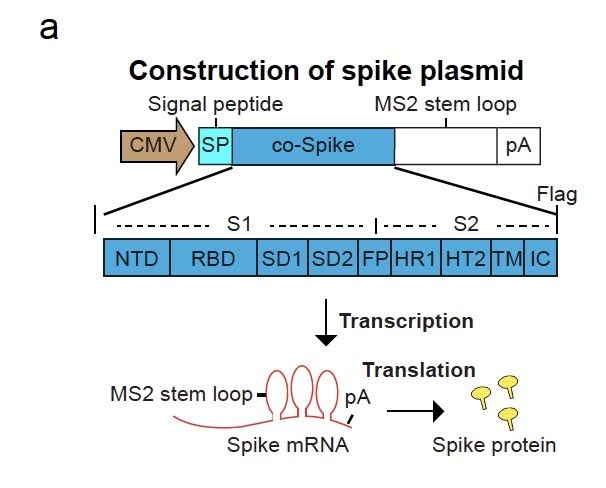
为了发生相似天然的免疫原,又不引起感染,研讨者经过将编码mRNA刺突蛋白(Spike)注入的病毒模仿颗粒(VSPs)内部,该病毒模仿颗粒由慢病毒颗粒衍生而来;研讨者还对病毒模仿颗粒外表的刺突蛋白进行了润饰。该研讨表征了新疫苗渠道的mRNA复制数、糖基化状况、转导功率和先天免疫特性。
重要的是,研讨显现ShaCoVacc经过单次打针,即可诱导激烈的刺突特异性体液免疫反响,并具有有用的中和活性。别的,研讨者运用肽微阵列公开了刺突特异性抗体的表位,并提醒了对特异性中和抗体灵敏的表位。这些成果支撑ShaCoVacc作为COVID-19的候选疫苗,可进一步开发,而病毒模仿颗粒可当作新式流行症的新疫苗渠道。
在曩昔的几十年中,许多疫苗渠道现已被同意用于商场或临床试验。减毒活疫苗是弱化的病原体,可引起激烈的体液和细胞免疫反响,但也有感染危险,尤其是对免疫功用低下的人。灭活疫苗可杀死具有完好结构的病原体并损坏其遗传物质,因而危险较低,但成效也较低。
蛋白质亚单位疫苗、DNA疫苗和mRNA疫苗一般是安全的,但很难从本质上反映出病毒免疫原的构象结构。病毒样颗粒(VLP)是残损颗粒,具有能够以其天然构象出现病毒刺突并引发构象依赖性中和抗体的才能。而更相似于病原体的VLP其外表有刺突结构,内部有编码抗原核酸。哪种疫苗渠道实在适用于SARS-CoV-2仍不知道,这使得开发新的疫苗渠道具有重要意义。因为在新冠患者恢复期中已检测到中和抗体,因而模仿SARS-CoV-2的疫苗能够将抗原传递给免疫体系,这与实在病毒的办法简直相同,然后激起相似的有用免疫呼应。
研讨者规划了一种候选疫苗,办法是将刺突蛋白包封在病毒模仿颗粒(VSP)中,并对其外表进行润饰。该病毒模仿颗粒以慢病毒颗粒的方式别离以mRNA和蛋白质模仿野生型SARS-CoV-2。假定,经过带着mRNA的慢病毒颗粒发生过程中,能够完成对全长刺突的表达。
为了将全长刺突mRNA包装到病毒模仿颗粒中,研讨者还规划了一个刺突构建体,该刺突构建体在其转录物上表达带有6X MS2 stem loop的刺突蛋白,这使得刺突mRNA经过与MS2外套交融的GagPol相互效果而被包装到病毒模仿颗粒中。
一起,作为包膜蛋白,刺突蛋白会主动组装到病毒模仿颗粒的膜中。
为了查看是否已将刺突蛋白mRNA依照规划包装到慢病毒颗粒中,研讨者进行了RT-qPCR,发现每个病毒模仿颗粒均匀有3或4个复制的刺突蛋白mRNA。为了验证刺突蛋白是否现已组装成病毒模仿颗粒及其糖基化状况,研讨者以整合缺点型慢病毒(IDLV)为对照对病毒模仿颗粒的裂解物进行了蛋白质印迹剖析。剖析发现,其成功润饰了带有或不带有病毒模仿颗粒骤变的刺突蛋白,一起能够装载更多的骤变此刺突蛋白。
因为糖基化影响疫苗的免疫原性和免疫优势,试验查看了病毒模仿颗粒外表刺突的糖基化状况。有必要留意一下的是,PNGase F处理后,S2带向下移动,标明病毒模仿颗粒上的刺突蛋白被N-衔接的糖基化润饰,这与质谱法提醒的SARS-CoV-2的近期发现共同。
接下来,研讨者将病毒模仿颗粒转导至293T细胞并评价了刺突蛋白的表达。在感染后36小时收成了细胞,进行Western印迹剖析。在这里,研讨者依然调查到病毒模仿颗粒在293T细胞中的刺突蛋白表达,标明VSV-G被共组装成病毒模仿颗粒,然后扩展了它们的向性。研讨者发现了两个首要的刺突带,可能是糖基化的全长单刺突及其二聚体/三聚体方式。
此外,研讨者运用共聚集剖析法对转染或转导的293T细胞进行了承认,其表达了刺突。为了查看病毒模仿颗粒的先天免疫特性,运用THP-1衍生的巨噬细胞作为核酸传感模型,发现I型干扰素(IFN)和IFN影响的基因ISG-15和视黄酸诱导的基因没有显着添加I(RIG-I)。因为带刺突的病毒模仿颗粒比野生型对应物更有用地掺入了刺突的mRNA和蛋白,因而研讨者挑选它作为体内评价的候选疫苗(指定为ShaCoVacc)。
为了取得ShaCoVacc的免疫原性,研讨者将候选疫苗打针到C57BL / 6J小鼠中。在接种疫苗后两周后,对小鼠血清进行了酶联免疫吸附测定(ELISA),以获取刺突特异性IgG。研讨者调查到了刺突特异性IgG的显着诱导。
为了评价中和抗体的发生,还运用了编码萤火虫荧光素酶的刺突假型HIV进行了中和测定——一种老练的伪病毒中和测定。风趣的是,在研讨中,单次打针ShaCoVacc能够诱导针对SARS-CoV-2的立刻有用免疫反响,而灭活疫苗则需求至少两次或三剂打针。
研讨者还采用了刺突假型慢病毒,该慢病毒编码GFP来转导Huh-7细胞。试验发现,用来自疫苗接种小鼠的1:40稀释血清进行的预培育简直彻底消除了荧光,这关于安慰剂组和阳性对照很显着。风趣的是,来自接种小鼠的血清在Huh-7细胞中没有按捺VSV-G假型慢病毒的转导,这标明中和抗体具有刺突特异性。
T细胞免疫应对一般关于疫苗操控病毒感染的功用很重要。可是,在COVID-19中,细胞因子的过度发生与症状严峻程度相关。因而,研讨团队以为,关于任何SARS5 CoV-2疫苗,细胞免疫都必须慎重。
在这项研讨中,经过模仿带有刺突衍生肽池的脾细胞来评价T细胞免疫反响。研讨者没有发现IFN-γ和IL-2的表达添加,这标明关于ShaCoVacc而言,刺突特异性细胞免疫反响并不显着。这与最近的灭活SARS-CoV-2疫苗研讨相共同,该疫苗具有维护效果,但未发现接种猕猴的淋巴细胞和要害细胞因子的百分比有显着改变。此外,在疫苗接种过程中未发现ShaCoVacc引起的体重减轻,标明无显着毒性。
经过解剖接种疫苗的小鼠,可进一步了解刺突特异性抗体的线性表位特征,研讨者运用了一种新开发的肽微阵列,其间包括掩盖刺突整个长度的短肽。研讨者发现,与疫苗接种组的某些刺突肽相对应的信号强度各不相同,安慰剂医治的小鼠则未调查到信号。
研讨团队还量化了别离针对S1域和受体结合域(RBD)的抗体的信号强度。接种小鼠的血清在两个结构域均引发了显着较高的信号,这与此前刺突特异性抗体的ELISA剖析和中和测定相吻合。
为了取得表位的全景图,他们制作了一切疫苗接种小鼠的热图,发现每只疫苗接种小鼠的抗原决定簇特征是不同的。可是,该研讨还发现了66.7%的接种小鼠有三个常见的表位(S2-22,S2-76和S2-83)。从恢复者血清中提取的针对该表位的抗体已显现出强壮的中和活性。有必要留意一下的是,S2-76和S2-83表位是保存的表位,并由SARS-CoV和SARS-CoV-2同享。
总的来说,该研讨经过模仿冠状病毒外表蛋白和内部核酸,然后结合了灭活疫苗和mRNA疫苗的功用,供给了一个新的疫苗渠道。因为SARS-CoV-2的资源有限,研讨者现在无法用实在病毒再次感染接种过的动物。未来,研讨者将进一步提醒了接种小鼠的表位概略和易受特定中和抗体影响的表位,这可能有助于药物和抗体的开发。





